Сучасний PRP: «Клінічний PRP»
За останні 10 років схема лікування PRP зазнала великих змін.Завдяки експериментальним і клінічним дослідженням ми тепер маємо краще розуміння фізіології тромбоцитів та інших клітин.Крім того, декілька високоякісних систематичних оцінок, мета-аналізів і рандомізованих контрольованих досліджень показали ефективність біотехнології PRP у багатьох галузях медицини, включаючи дерматологію, кардіохірургію, пластичну хірургію, ортопедичну хірургію, лікування болю, захворювання хребта та спортивну медицину. .
Поточною характеристикою PRP є його абсолютна концентрація тромбоцитів, яка змінюється від початкового визначення PRP (включно з концентрацією тромбоцитів, вищою за базове значення) до понад 1 × 10 6/мкл або приблизно в 5 разів перевищує мінімальну концентрацію тромбоцитів у тромбоцитах з базова лінія.У великому огляді Fadadu et al.Було оцінено 33 системи та протоколи PRP.Кількість тромбоцитів у кінцевому препараті PRP, виробленому деякими з цих систем, нижча, ніж у цільній крові.Вони повідомили, що тромбоцитарний фактор PRP збільшився до 0,52 за допомогою набору для одноразового обертання (Selphyl ®).Навпаки, EmCyte Genesis PurePRPII ® із подвійним обертанням Концентрація тромбоцитів, створена пристроєм, є найвищою (1,6 × 10 6 /мкл) .
Очевидно, що методи in vitro та методи на тваринах не є ідеальним дослідницьким середовищем для успішної трансформації в клінічну практику.Подібним чином дослідження порівняння пристроїв не підтверджує це рішення, оскільки вони показують, що концентрація тромбоцитів між пристроями PRP сильно відрізняється.На щастя, завдяки технології та аналізу на основі протеоміки ми можемо покращити наше розуміння функцій клітин у PRP, які впливають на результати лікування.Перш ніж досягти консенсусу щодо стандартизованих препаратів і форм PRP, PRP має відповідати клінічним рецептам PRP для сприяння істотним механізмам відновлення тканин і прогресивним клінічним результатам.
Клінічна формула PRP
В даний час ефективний клінічний PRP (C-PRP) характеризується як складна композиція аутологічних багатоклітинних компонентів у невеликому об’ємі плазми, отриманої з частини периферичної крові після центрифугування.Після центрифугування PRP та його нетромбоцитарні клітинні компоненти можуть бути виділені з концентраційного пристрою відповідно до різних щільностей клітин (з яких щільність тромбоцитів є найнижчою).
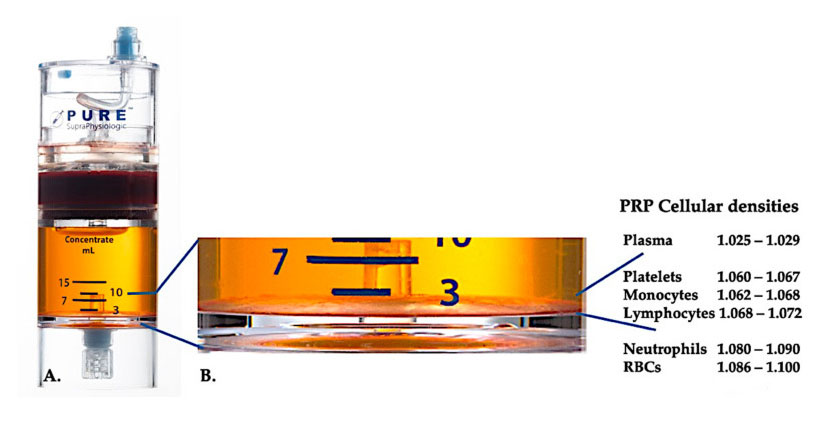
Використовуйте PurePRP-SP ® Обладнання для розділення клітинної щільності (EmCyte Corporation, Форт-Майєрс, Флорида, США) використовувалося для цільної крові після двох процедур центрифугування.Після першого процесу центрифугування компонент цільної крові було розділено на два основні шари, суспензію тромбоцитів (збідненої) плазми та шар еритроцитів.У A другий етап центрифугування завершено.Фактичний об’єм PRP можна отримати для застосування пацієнтом.Збільшення в B показує, що в нижній частині обладнання є організований багатокомпонентний коричневий шар осідання еритроцитів (представлений синьою лінією), який містить високі концентрації тромбоцитів, моноцитів і лімфоцитів, виходячи з градієнта щільності.У цьому прикладі, відповідно до протоколу підготовки C-PRP з низьким вмістом нейтрофілів, буде виділено мінімальний відсоток нейтрофілів (<0,3%) і еритроцитів (<0,1%).
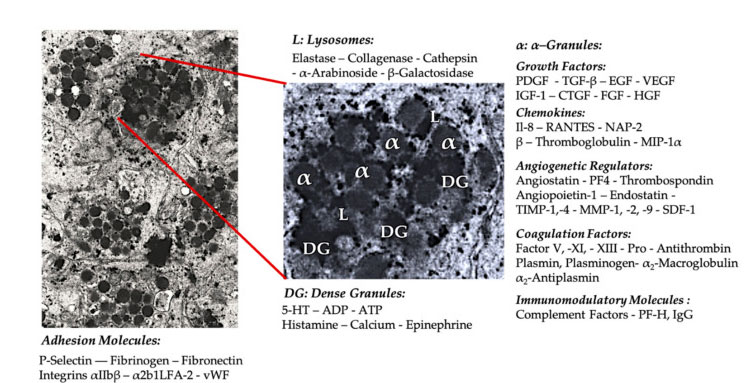
Тромбоцитарна гранула
У ранньому клінічному застосуванні PRP α-гранули є найбільш часто згадуваною внутрішньою структурою тромбоцитів, оскільки вони містять фактори згортання крові, велику кількість PDGF і ангіогенних регуляторів, але мають незначну тромбогенну функцію.Інші фактори включають менш відомі компоненти хемокінів і цитокінів, такі як тромбоцитарний фактор 4 (PF4), претромбоцитарний основний білок, Р-селектин (активатор інтегрину) і хемокін RANTES (регулюється активацією, експресією нормальних Т-клітин і, ймовірно, секретуючий).Загальна функція цих специфічних компонентів тромбоцитарних гранул полягає в залученні та активації інших імунних клітин або індукції запалення ендотеліальних клітин.
Щільні зернисті компоненти, такі як АДФ, серотонін, поліфосфат, гістамін і адреналін, більш неявно використовуються як регулятори активації тромбоцитів і тромбозу.Найважливіше те, що багато з цих елементів мають функцію модифікації імунних клітин.АДФ тромбоцитів розпізнається рецептором P2Y12ADP на дендритних клітинах (ДК), таким чином посилюючи ендоцитоз антигену.DC (антигенпрезентуюча клітина) дуже важлива для ініціації Т-клітинної імунної відповіді та контролю захисної імунної відповіді, яка поєднує вроджену імунну систему та адаптивну імунну систему.Крім того, аденозинтрифосфат тромбоцитів (АТФ) надсилає сигнали через Т-клітинний рецептор P2X7, що призводить до збільшення диференціювання Т-хелперних клітин CD4 у прозапальні Т-хелперні клітини 17 (Th17).Інші компоненти щільних гранул тромбоцитів (такі як глутамат і серотонін) індукують міграцію Т-клітин і збільшують диференціацію моноцитів до DC відповідно.У PRP ці імуномодулятори, отримані з щільних частинок, дуже збагачені та мають значні імунні функції.
Кількість прямих і непрямих потенційних взаємодій між тромбоцитами та іншими (рецепторними) клітинами велика.Таким чином, застосування PRP в місцевому середовищі патологічної тканини може викликати різноманітні запальні ефекти.
Концентрація тромбоцитів
C-PRP має містити клінічні дози концентрованих тромбоцитів для отримання корисних терапевтичних ефектів.Тромбоцити в C-PRP повинні стимулювати клітинну проліферацію, синтез мезенхімальних і нейротрофічних факторів, сприяти міграції хемотаксичних клітин і стимулювати імунорегуляторну активність, як показано на малюнку.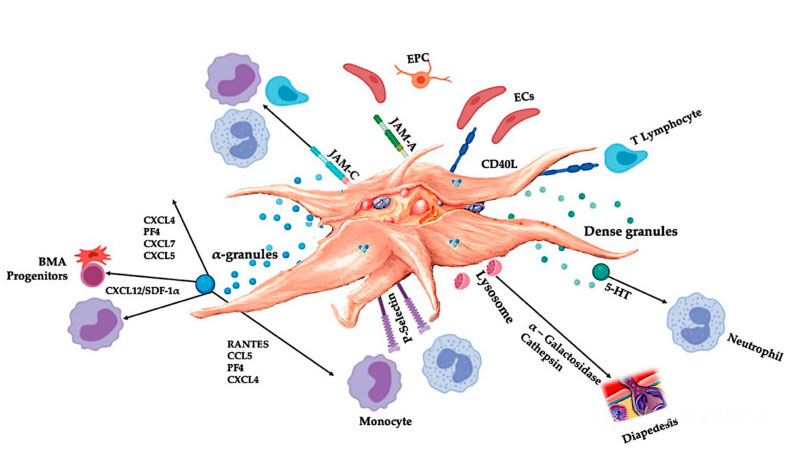
Активовані тромбоцити, вивільнення PGF і молекули адгезії опосередковують різноманітні клітинні взаємодії: хемотаксис, клітинну адгезію, міграцію та диференціювання клітин, а також регулюють діяльність імунної регуляції.Ці взаємодії між клітинами тромбоцитів сприяють ангіогенезу та запальній активності та, зрештою, стимулюють процес відновлення тканин.Абревіатури: BMA: аспірат кісткового мозку, EPC: ендотеліальні клітини-попередники, EC: ендотеліальні клітини, 5-HT: 5-гідрокситриптамін, RANTES: активована регуляція нормальної експресії Т-клітин і передбачуваної секреції, JAM: тип молекули адгезії, CD40L: кластер 40 ліганд, SDF-1 α: фактор-1 α, отриманий із стромальних клітин, CXCL: ліганд хемокіну (мотив CXC), PF4: тромбоцитарний фактор 4. Адаптовано з Everts et al.
Маркс був першим, хто довів, що загоєння кісток і м’яких тканин посилюється, а мінімальна кількість тромбоцитів становить 1 × 10 6 /мкл. Ці результати були підтверджені в дослідженні поперекового зрощення через міжхребцевий отвір, коли доза тромбоцитів була більшою, ніж 1,3 × При 106 тромбоцитів/мкл це дослідження продемонструвало більше злиття.Крім того, Giusti et al.Виявлено 1,5 × Механізм відновлення тканин при дозі 109 вимагає тромбоцитів/мл для індукування функціонального ангіогенезу через активність ендотеліальних клітин.В останньому дослідженні вищі концентрації знижували потенціал ангіогенезу тромбоцитів у фолікулах та навколо них.Крім того, попередні дані показали, що доза PRP також впливатиме на результати лікування.Таким чином, щоб значно індукувати реакцію ангіогенезу та стимулювати клітинну проліферацію та клітинну міграцію, C-PRP має містити щонайменше 7,5 у 5-мл PRP лікувальній пляшці × 10 9 може доставляти тромбоцити.
На додаток до залежності від дози, ефект PRP на активність клітин, здається, сильно залежить від часу.Софі та ін.Ці результати свідчать про те, що короткочасний вплив лізатів тромбоцитів людини може стимулювати проліферацію кісткових клітин і хемотаксис.Навпаки, тривалий вплив PRP призведе до зниження рівня лужної фосфатази та утворення мінералів.
еритроцитів
Еритроцити відповідають за транспортування кисню до тканин і перенесення вуглекислого газу з тканин до легенів.Вони не мають ядра і складаються з молекул гема, які зв’язуються з білками.Компоненти заліза та гему в еритроцитах сприяють поєднанню кисню та вуглекислого газу.Як правило, життєвий цикл еритроцитів становить близько 120 днів.Вони видаляються з кровообігу макрофагами через процес, який називається старінням еритроцитів.Еритроцити у зразках PRP можуть бути пошкоджені в умовах зсуву (наприклад, хірургічне втручання з цільною кров’ю, імуноопосередкований процес, окислювальний стрес або неадекватна схема концентрації PRP).Таким чином, клітинна мембрана еритроцитів розкладається і вивільняє токсичний гемоглобін (Hb), виміряний вільним гемоглобіном плазми (PFH), гемом і залізом.].PFH і продукти його розпаду (гем і залізо) разом призводять до шкідливих і цитотоксичних ефектів на тканини, що призводить до окислювального стресу, втрати оксиду азоту, активації шляхів запалення та імуносупресії.Ці наслідки зрештою призведуть до дисфункції мікроциркуляції, місцевого звуження судин і пошкодження судин, а також до серйозного пошкодження тканин.
Найважливішим є те, що коли еритроцити, що містять C-PRP, доставляються до тканини, це викликає місцеву реакцію, звану ериптозом, яка запускає вивільнення ефективного цитокіну та інгібітора міграції макрофагів.Цей цитокін пригнічує міграцію моноцитів і макрофагів.Він подає сильні прозапальні сигнали до навколишніх тканин, пригнічує міграцію стовбурових клітин і проліферацію фібробластів і призводить до значної локальної дисфункції клітин.Тому важливо обмежити забруднення еритроцитів у препаратах PRP.Крім того, ніколи не була визначена роль еритроцитів у регенерації тканин.Адекватне центрифугування та процес підготовки C-PRP зазвичай зменшують або навіть усувають присутність еритроцитів, таким чином уникаючи несприятливих наслідків гемолізу та поліцитемії.
Лейкоцити в C-PRP
Наявність лейкоцитів у препаратах PRP залежить від лікувального обладнання та схеми приготування.У обладнанні PRP на основі плазми лейкоцити повністю видаляються;Проте лейкоцити були значно концентровані в препараті PRP коричневого шару осідання еритроцитів.Завдяки своїм імунним механізмам і захисним механізмам господаря білі кров’яні клітини значною мірою впливають на внутрішню біологію гострих і хронічних захворювань тканин.Ці функції будуть розглянуті далі.Таким чином, присутність специфічних лейкоцитів у C-PRP може викликати значні клітинні та тканинні ефекти.Більш конкретно, різні PRP системи осідання еритроцитів у коричнево-жовтому шарі використовують різні схеми підготовки, таким чином створюючи різну частку нейтрофілів, лімфоцитів і моноцитів у PRP.Еозинофіли та базофіли не можна виміряти в препаратах PRP, оскільки їхні клітинні мембрани надто крихкі, щоб протистояти відцентровим силам обробки.
нейтрофіли
Нейтрофіли є основними лейкоцитами в багатьох шляхах загоєння.Ці шляхи поєднуються з антимікробними білками, присутніми в тромбоцитах, утворюючи щільний бар’єр проти інвазивних патогенів.Наявність нейтрофілів визначається відповідно до мети лікування C-PRP.Підвищений рівень запалення тканин може знадобитися при лікуванні хронічних ран PRP біотерапією або при застосуванні, спрямованому на ріст або загоєння кісток.Важливо, що додаткові функції нейтрофілів були виявлені в кількох моделях, підкреслюючи їх роль у ангіогенезі та відновленні тканин.Однак нейтрофіли також можуть викликати шкідливі наслідки, тому вони непридатні для деяких застосувань.Чжоу і Ван довели, що використання PRP, багатого нейтрофілами, може призвести до збільшення співвідношення колагену типу III до колагену типу I, таким чином загострюючи фіброз і знижуючи міцність сухожиль.Іншими шкідливими характеристиками, опосередкованими нейтрофілами, є вивільнення запальних цитокінів і матриксних металопротеїназ (ММР), які можуть сприяти запаленню та катаболізму при застосуванні до тканин.
Лейкомоноцит
У C-PRP мононуклеарні Т- і В-лімфоцити більш концентровані, ніж будь-які інші лейкоцити.Вони тісно пов'язані з клітинним цитотоксичним адаптивним імунітетом.Лімфоцити можуть запускати клітинні реакції для боротьби з інфекцією та адаптації до загарбників.Крім того, цитокіни Т-лімфоцитів (інтерферон-γ [IFN-γ] та інтерлейкін-4 (IL-4) посилюють поляризацію макрофагів. Verassar та ін. Доведено, що звичайні Т-лімфоцити можуть опосередковано сприяти загоєнню тканин у моделі миші, регулюючи диференціацію моноцитів і макрофагів.
Моноцит – мультипотентна репараційна клітина
Відповідно до використовуваного пристрою для приготування PRP, моноцити можуть виступати або не бути у пляшці для лікування PRP.На жаль, їх продуктивність і здатність до регенерації рідко обговорюються в літературі.Тому мало уваги приділяється моноцитам у методі приготування або кінцевій формулі.Група моноцитів гетерогенна, походить від клітин-попередників у кістковому мозку та транспортується до периферичних тканин через шлях гемопоетичних стовбурових клітин відповідно до стимуляції мікрооточення.Під час гомеостазу та запалення циркулюючі моноцити залишають кровотік і рекрутуються до пошкоджених або деградованих тканин.Вони можуть діяти як макрофаги (M Φ) Ефекторні клітини або клітини-попередники.Моноцити, макрофаги та дендритні клітини представляють собою мононуклеарну фагоцитарну систему (MPS). Типовою особливістю MPS є пластичність моделі експресії генів і функціональне перекриття між цими типами клітин.У дегенерованих тканинах резидентні макрофаги, локально діючі фактори росту, прозапальні цитокіни, апоптотичні або некротичні клітини та мікробні продукти ініціюють моноцити до диференціювання в клітинні групи MPS.Припустимо, що коли C-PRP, що містить високопродуктивні моноцити, вводиться в місцеве мікрооточення захворювання, моноцити, швидше за все, диференціюються в M Φ, щоб викликати значні зміни клітин.
Від моноцита до M Φ У процесі трансформації специфічний M Φ Фенотип.За останні десять років була розроблена модель, яка об’єднує M Φ Складний механізм активації описується як поляризація двох протилежних станів: M Φ фенотипу 1 (M Φ 1, класична активація) і M Φ фенотипу 2 (M Φ 2, альтернативна активація).M Φ 1 характеризується секрецією запальних цитокінів (IFN-γ) і оксиду азоту для створення ефективного механізму знищення патогенів.M Φ Фенотип також продукує фактор росту ендотелію судин (VEGF) і фактор росту фібробластів (FGF).M Φ Фенотип складається з протизапальних клітин з високим фагоцитозом.M Φ 2 Виробляють компоненти позаклітинного матриксу, ангіогенез і хемокіни, а також інтерлейкін 10 (IL-10).Окрім захисту від патогенів, M Φ також може зменшити запалення та сприяти відновленню тканин.Слід зазначити, що M Φ 2 підрозділяється на M in vitro Φ 2a、M Φ 2b і M Φ 2. Це залежить від стимулу.Трансляція цих підтипів in vivo є важкою, оскільки тканина може містити змішані M Φ групи.Цікаво, що на основі місцевих сигналів навколишнього середовища та рівнів IL-4 прозапальний M Φ 1 може бути перетворений для сприяння репарації M Φ 2。 З цих даних розумно припустити, що існують високі концентрації моноцитів і препаратів M Φ C-PRP можуть сприяти кращому відновленню тканин, оскільки вони мають протизапальну репарацію тканин і здатність передавати клітинний сигнал.
Плутане визначення фракції лейкоцитів у PRP
Наявність лейкоцитів у флаконах для лікування PRP залежить від пристрою для приготування PRP і може мати значні відмінності.Існує багато суперечок щодо існування лейкоцитів та їх внеску в різні суб-PRP продукти (такі як PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF і L-PRF). У нещодавньому огляді шість рандомізованих контрольовані дослідження (рівень доказовості 1) і три проспективні порівняльні дослідження (рівень доказовості 2) включали 1055 пацієнтів, що вказує на подібну безпеку LR-PRP і LP-PRP.Автор дійшов висновку, що побічна реакція PRP не може бути безпосередньо пов'язана з концентрацією лейкоцитів.В іншому дослідженні LR-PRP не змінив запальний інтерлейкін (IL-1) при ОА колінного суглоба β, IL-6, IL-8 та IL-17).Ці результати підтверджують точку зору, що роль лейкоцитів у біологічній активності PRP in vivo може походити від перехресних перешкод між тромбоцитами та лейкоцитами.Ця взаємодія може сприяти біосинтезу інших факторів (таких як ліпоксиген), які можуть компенсувати або сприяти регресії запалення.Після початкового вивільнення запальних молекул (арахідонової кислоти, лейкотрієну та простагландину) ліпокисень А4 вивільняється з активованих тромбоцитів, щоб запобігти активації нейтрофілів.Саме в цьому середовищі фенотип M Φ змінюється з M Φ 1 на M Φ 2. Крім того, з’являється все більше доказів того, що циркулюючі мононуклеарні клітини можуть диференціюватися в різноманітні нефагоцитарні типи клітин завдяки своїй плюрипотентності.
Тип PRP впливатиме на культуру MSC.Порівняно з чистими зразками PRP або PPP, LR-PRP може індукувати значно більшу проліферацію МСК кісткового мозку (BMMSC) із швидшим вивільненням і кращою біологічною активністю PGF.Усі ці характеристики сприяють додаванню моноцитів у пляшку для лікування PRP та визнанню їхньої імуномодулюючої здатності та потенціалу диференціації.
Вроджена та адаптивна імунна регуляція PRP
Найбільш відомою фізіологічною функцією тромбоцитів є контроль кровотечі.Вони накопичуються в місці пошкодження тканин і пошкоджених кровоносних судинах.Ці події спричинені експресією інтегринів і селектинів, які стимулюють адгезію та агрегацію тромбоцитів.Пошкоджений ендотелій ще більше посилює цей процес, а оголений колаген та інші протеїни субендотеліального матриксу сприяють глибокій активації тромбоцитів.У цих випадках була доведена важлива роль взаємодії між фактором фон Віллебранда (vWF) і глікопротеїном (GP), особливо GP-Ib.Після активації тромбоцитів тромбоцитарні α-、 щільні, лізосомні та Т-гранули регулюють екзоцитоз і вивільняють свій вміст у позаклітинне середовище.
Молекула адгезії тромбоцитів
Щоб краще зрозуміти роль PRP у запальних тканинах і тромбоцитах в імунній відповіді, ми повинні зрозуміти, як різні поверхневі рецептори тромбоцитів (інтегрини) і молекули адгезії (JAM) і клітинні взаємодії можуть ініціювати критичні процеси у вродженому та адаптованому імунітеті.
Інтегрини — це молекули адгезії на клітинній поверхні, що містяться в різних типах клітин і експресуються у великих кількостях на тромбоцитах.Інтегрини включають a5b1, a6b1, a2b1 LFA-2 (GPIa/IIa) та aIIbb3 (GPIIb/IIIa).Зазвичай вони існують у статичному стані з низькою спорідненістю.Після активації вони переходять у стан високої афінності зв'язування ліганду.Інтегрини виконують різні функції на тромбоцитах і беруть участь у взаємодії тромбоцитів з декількома типами лейкоцитів, ендотеліальними клітинами та позаклітинним матриксом.Крім того, комплекс GP-Ib-V-IX експресується на мембрані тромбоцитів і є основним рецептором для зв’язування з von vWF.Ця взаємодія опосередковує початковий контакт між тромбоцитами та відкритими субендотеліальними структурами.Інтегрин тромбоцитів і комплекс ГП мають відношення до різноманітних запальних процесів і відіграють важливу роль у формуванні тромбоцитарно-лейкоцитарного комплексу.Зокрема, інтегрин aIIbb3 необхідний для утворення стабільного комплексу шляхом поєднання фібриногену з рецептором антигену макрофага 1 (Mac-1) на нейтрофілах.
Тромбоцити, нейтрофіли та ендотеліальні клітини судин експресують специфічні молекули клітинної адгезії, звані селектином.За умов запалення тромбоцити експресують P-селектин і L-селектин нейтрофілів.Після активації тромбоцитів P-селектин може зв’язуватися з лігандом PSGL-1, який існує на нейтрофілах і моноцитах.Крім того, зв’язування PSGL-1 ініціює внутрішньоклітинну каскадну реакцію сигналу, яка активує нейтрофіли через нейтрофільний інтегрин Mac-1 і пов’язаний з функцією лімфоцитів антиген 1 (LFA-1).Активований Mac-1 зв’язується з GPIb або GPIIb/IIIa на тромбоцитах через фібриноген, таким чином стабілізуючи взаємодію між нейтрофілами та тромбоцитами.Крім того, активований LFA-1 може поєднуватися з молекулою міжклітинної адгезії тромбоцитів 2 для подальшої стабілізації комплексу нейтрофіл-тромбоцит для сприяння довгостроковій адгезії з клітинами.
Тромбоцити і лейкоцити відіграють ключову роль у вроджених і адаптивних імунних реакціях
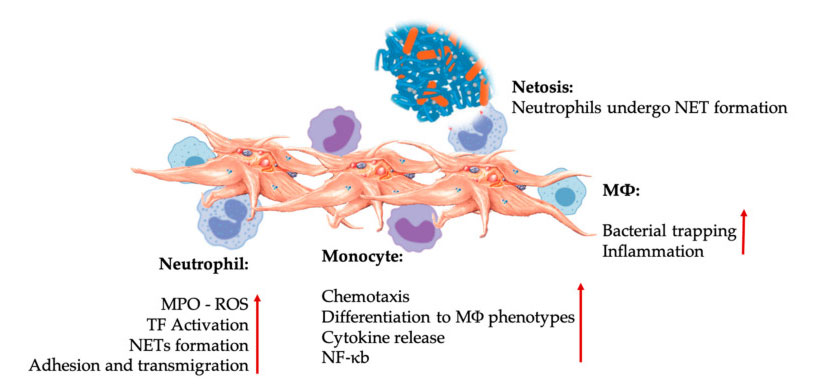
Тіло може розпізнавати сторонні тіла та пошкоджені тканини при гострих або хронічних захворюваннях, щоб ініціювати каскадну реакцію загоєння ран і шлях запалення.Вроджена та адаптивна імунні системи захищають хазяїна від інфекції, а лейкоцити відіграють важливу роль у перекритті між двома системами.Зокрема, моноцити, макрофаги, нейтрофіли та природні клітини-кілери відіграють ключову роль у вродженій системі, тоді як лімфоцити та їх підгрупи відіграють подібну роль у адаптивній імунній системі.
Взаємодія тромбоцитів і лейкоцитів у взаємодіях клітин вродженого імунітету.Тромбоцити взаємодіють з нейтрофілами і моноцитами, і, нарешті, з M Φ Взаємодіють, регулюють і збільшують їх ефекторні функції.Ці взаємодії тромбоцитів і лейкоцитів призводять до запалення через різні механізми, включаючи NETosis.Скорочення: MPO: мієлопероксидаза, ROS: активні форми кисню, TF: тканинний фактор, NET: позаклітинна пастка нейтрофілів, NF-κ B: ядерний фактор каппа B, M Φ: макрофаги.
Вроджена імунна система
Роль вродженої імунної системи полягає в тому, щоб неспецифічно ідентифікувати інвазивні мікроорганізми або фрагменти тканин і стимулювати їх очищення.Коли певні молекулярні структури, які називаються рецепторами розпізнавання патернів експресії (PRR), поєднуються з молекулярними патернами, пов’язаними з патогенами, і молекулярними патернами, пов’язаними з пошкодженням, активується вроджена імунна система.Існує багато видів PRR, включаючи Toll-подібний рецептор (TLR) і RIG-1-подібний рецептор (RLR).Ці рецептори можуть активувати основний фактор транскрипції каппа B (NF-κ B). Він також регулює численні аспекти вродженої та адаптивної імунної відповіді.Цікаво, що тромбоцити також експресують різноманітні імунорегуляторні рецепторні молекули на своїй поверхні та в цитоплазмі, такі як P-селектин, ліганд трансмембранного білка CD40 (CD40L), цитокіни (такі як IL-1 β, TGF- β) та специфічний для тромбоцитів TLR. Таким чином, тромбоцити можуть взаємодіяти з різними імунними клітинами.
Взаємодія тромбоцитів і білих клітин у вродженому імунітеті
Коли тромбоцити потрапляють або вторгаються в кровотік або тканину, тромбоцити є однією з клітин, які першими виявляють пошкодження ендотелію та мікробні патогени.Агрегація тромбоцитів і сприяння вивільненню агоністів тромбоцитів АДФ, тромбіну та vWF, що призводить до активації тромбоцитів і експресії хемокінових рецепторів тромбоцитів C, CC, CXC і CX3C, таким чином викликаючи тромбоцити в інфікованій ділянці або пошкодженні.
Вроджена імунна система генетично налаштована на виявлення загарбників, таких як віруси, бактерії, паразити та токсини, або рани та рани тканин.Це неспецифічна система, тому що будь-який збудник буде ідентифікований як чужорідний або невласний і швидко знайдений.Вроджена імунна система спирається на набір білків і фагоцитів, які розпізнають добре збережені характеристики патогенів і швидко активують імунну відповідь, щоб допомогти усунути загарбників, навіть якщо господар ніколи раніше не піддавався впливу конкретних патогенів.
Нейтрофіли, моноцити та дендритні клітини є найпоширенішими клітинами вродженого імунітету в крові.Їх залучення необхідне для адекватної ранньої імунної відповіді.Коли PRP використовується в регенеративній медицині, взаємодія тромбоцитів і білих клітин регулює запалення, загоєння ран і відновлення тканин.TLR-4 на тромбоцитах стимулює взаємодію тромбоцитів і нейтрофілів, яка регулює так званий окислювальний вибух лейкоцитів, регулюючи вивільнення активних форм кисню (ROS) і мієлопероксидази (MPO) з нейтрофілів.Крім того, взаємодія між тромбоцитами-нейтрофілами та дегрануляцією нейтрофілів призводить до утворення нейтрофілів-позаклітинних пасток (NET).NET складаються з ядра нейтрофілів та іншого внутрішньоклітинного вмісту нейтрофілів, який може захоплювати бактерії та вбивати їх через NETosis.Утворення NET є важливим механізмом знищення нейтрофілів.
Після активації тромбоцитів моноцити можуть мігрувати до хворих і дегенеративних тканин, де вони здійснюють адгезійну діяльність і виділяють запальні молекули, які можуть змінити хемотаксис і протеолітичні властивості.Крім того, тромбоцити можуть індукувати активацію NF-κ B моноцитів для регулювання ефекторної функції моноцитів, яка є ключовим медіатором запальної відповіді та активації та диференціювання імунних клітин.Тромбоцити додатково сприяють ендогенному окислювальному вибуху моноцитів, щоб сприяти знищенню фагоцитарних патогенів.Вивільнення MPO опосередковується прямою взаємодією між тромбоцитом і моноцитом CD40L-MAC-1.Цікаво, що коли Р-селектин активує тромбоцити при гострих і хронічних запальних станах тканин, хемокіни, отримані з тромбоцитів PF4, RANTES, IL-1 β і CXCL-12, можуть запобігати спонтанному апоптозу моноцитів, але сприяти їх диференціації в макрофаги.
Адаптивна імунна система
Після того, як неспецифічна вроджена імунна система розпізнає мікробне або тканинне пошкодження, специфічна адаптивна імунна система бере на себе роботу.Адаптивні системи включають антигензв'язуючі В-лімфоцити (В-клітини) і звичайні Т-лімфоцити (Treg), які координують очищення патогенів.Т-клітини можна приблизно розділити на Т-клітини-хелпери (Th-клітини) і цитотоксичні Т-клітини (Tc-клітини, також відомі як Т-клітини-кілери).Клітини Th далі поділяються на клітини Th1, Th2 і Th17, які виконують ключові функції при запаленні.Th-клітини можуть виділяти прозапальні цитокіни (наприклад, IFN-γ、 TNF-β) та кілька інтерлейкінів (наприклад, IL-17). Вони особливо ефективні в запобіганні внутрішньоклітинної вірусної та бактеріальної інфекції. Th-клітини стимулюють проліферацію та диференціювання клітин, які беруть участь у імунна відповідь Тс-клітини є ефекторними клітинами, які можуть елімінувати цільові внутрішньоклітинні та позаклітинні мікроорганізми та клітини.
Цікаво, що клітини Th2 виробляють IL-4 і впливають на M Φ поляризацію, M Φ на керовану регенерацію M Φ 2 фенотип, тоді як IFN- γ M Φ змінюється на запальний фенотип M Φ 1, який залежить від дози та часу цитокінів.Після активації IL-4 M Φ 2 індукує клітини Treg диференціюватися в клітини Th2, а потім виробляє додатковий IL-4 (петля позитивного зворотного зв’язку).Th клітини перетворюють M Φ Фенотип спрямований на регенеративний фенотип у відповідь на біологічні агенти тканинного походження.Цей механізм заснований на доказах того, що Th-клітини відіграють значну роль у контролі запалення та відновленні тканин.
Взаємодія тромбоцитів і білих клітин в адаптивному імунітеті
Адаптивна імунна система використовує антиген-специфічні рецептори і запам’ятовує збудників, з якими раніше стикалися, і знищує їх, коли згодом стикається з господарем.Однак ці адаптивні імунні реакції розвивалися повільно.Коніас та ін.Це показує, що тромбоцитарний компонент сприяє сприйняттю ризику та відновленню тканин, і що взаємодія між тромбоцитами та лейкоцитами сприяє активації адаптивної імунної відповіді.
Під час адаптивної імунної відповіді тромбоцити сприяють відповідям моноцитів і макрофагів через дозрівання клітин DC і NK, що призводить до специфічних відповідей Т-клітин і В-клітин.Таким чином, компоненти тромбоцитарних гранул безпосередньо впливають на адаптивний імунітет шляхом експресії CD40L, молекули, яка є важливою для регуляції адаптивної імунної відповіді.Тромбоцити через CD40L не тільки відіграють роль у презентації антигену, але також впливають на реакцію Т-клітин.Лю та ін.Було виявлено, що тромбоцити комплексно регулюють відповідь Т-клітин CD4.Ця диференційована регуляція підмножин Т-клітин CD4 означає, що тромбоцити сприяють реакції Т-клітин CD4 на запальні стимули, таким чином викликаючи сильні прозапальні та протизапальні реакції.
Тромбоцити також регулюють опосередковану В-клітинами адаптивну відповідь на мікробні патогени.Добре відомо, що CD40L на активованих Т-клітинах CD4 запускатиме CD40 В-клітин, забезпечуючи другий сигнал, необхідний для залежної від Т-клітин активації В-лімфоцитів, подальшої конверсії алотипу та диференціації та проліферації В-клітин.Загалом результати чітко показують різні функції тромбоцитів у адаптивному імунітеті, вказуючи на те, що тромбоцити з’єднують взаємодію між Т-клітинами та В-клітинами через CD40-CD40L, таким чином підсилюючи залежну від Т-клітин відповідь В-клітин.Крім того, тромбоцити багаті рецепторами клітинної поверхні, які можуть сприяти активації тромбоцитів і вивільненню великої кількості запальних і біологічно активних молекул, що зберігаються в різних частинках тромбоцитів, таким чином впливаючи на вроджену та адаптивну імунну відповідь.
Розширена роль тромбоцитарного серотоніну в PRP
Серотонін (5-гідрокситриптамін, 5-HT) відіграє ключову роль у центральній нервовій системі (ЦНС), включаючи толерантність до болю.Підраховано, що більша частина 5-НТ людини виробляється в шлунково-кишковому тракті, а потім через кровообіг, де він поглинається тромбоцитами через транспортер зворотного захоплення серотоніну та зберігається у щільних частинках у високій концентрації (65 ммоль/л).5-HT є добре відомим нейромедіатором і гормоном, який допомагає регулювати різні нейропсихологічні процеси в ЦНС (центральний 5-HT).Однак більша частина 5-НТ існує поза ЦНС (периферичний 5-НТ), і він бере участь у регуляції системних і клітинних біологічних функцій багатьох систем органів, включаючи серцево-судинну, легеневу, шлунково-кишкову, сечостатеву та функціональну системи тромбоцитів.5-HT має залежний від концентрації метаболізм у різних типах клітин, включаючи адипоцити, епітеліальні клітини та лейкоцити.Периферичний 5-HT також є потужним імуномодулятором, який може стимулювати або пригнічувати запалення та впливати на різні імунні клітини через свій специфічний рецептор 5-HT (5HTR).
Паракринний і аутокринний механізм ГТ
Активність 5-HT опосередкована його взаємодією з 5HTR, яка є надродиною з семи членів (5-HT 1 – 7) і щонайменше 14 різних підтипів рецепторів, включаючи нещодавно відкритого члена 5-HT 7, його периферичний і функцію в лікуванні болю.У процесі дегрануляції тромбоцитів активовані тромбоцити виділяють велику кількість тромбоцитарного 5-HT, який може сприяти скороченню судин і стимулювати активацію прилеглих тромбоцитів і лімфоцитів через експресію 5-HTR на ендотеліальних клітинах, гладком’язових клітинах і імунні клітини.Пакала та ін.Було вивчено мітотичний ефект 5-НТ на ендотеліальні клітини судин і визначено потенціал сприяння росту пошкоджених кровоносних судин шляхом стимулювання ангіогенезу.Як регулюються ці процеси, до кінця не зрозуміло, але це може включати диференціальні двосторонні сигнальні шляхи в мікросхемі тканини для регулювання функцій судинних ендотеліальних клітин і гладком’язових клітин, фібробластів і імунних клітин через специфічні рецептори 5-HT на цих клітинах. .Було описано автокринну функцію тромбоцитарного 5-HT після активації тромбоцитів [REF].Вивільнення 5-НТ посилює активацію тромбоцитів і залучення циркулюючих тромбоцитів, що призводить до активації сигнальних каскадних реакцій і передніх ефекторів, що підтримують реактивність тромбоцитів.
Імуномодулюючий ефект 5-НТ
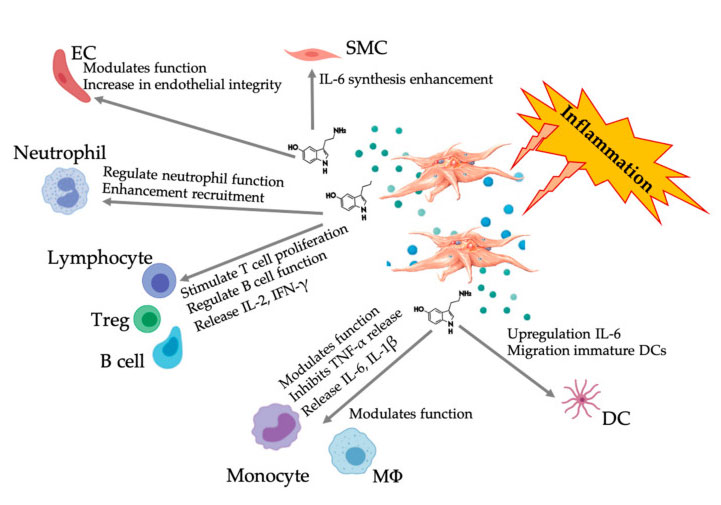
Все більше доказів показує, що серотонін може відігравати певну роль у різних 5HTR як імуномодулятор.Відповідно до 5HTR, що експресується в різних лейкоцитах, залучених у запальну реакцію, 5-HT, отриманий з тромбоцитів, діє як імунний регулятор як у вродженій, так і в адаптованій імунній системі.5-HT може стимулювати проліферацію Treg і регулювати функції B-клітин, природних клітин-кілерів і нейтрофілів шляхом залучення DC і моноцитів до вогнища запалення.Недавні дослідження показали, що отриманий з тромбоцитів 5-НТ може регулювати функцію імунних клітин за певних умов.Таким чином, за допомогою C-PRP концентрація тромбоцитів, що перевищує 1 × 10 6/мкл, може значно допомогти транспортувати концентрацію 5-HT, отриману з великих тромбоцитів, до тканини.У мікрооточенні, яке характеризується запальними компонентами, PRP може взаємодіяти з декількома імунними клітинами, які відіграють ключову роль у цих патологіях, що може вплинути на клінічні результати.
Малюнок, що відображає багатогранну відповідь 5-НТ після активації запальних тромбоцитів PRP.Після активації тромбоцитів, тромбоцити вивільняють свої гранули, включаючи 5-НТ у щільних гранулах, який має широкий спектр диференціальних ефектів на різні імунні клітини, ендотеліальні клітини та гладком’язові клітини.Абревіатури: SMC: гладком’язові клітини, EC: ендотеліальні клітини, Treg: звичайні Т-лімфоцити, M Φ: макрофаги, DC: дендритні клітини, IL: інтерлейкін, IFN-γ: Інтерферон γ。 Модифіковано та адаптовано з Everts et al.та Халл та ін.
Знеболюючий ефект PRP
Активовані тромбоцити вивільняють багато прозапальних і протизапальних медіаторів, які можуть не тільки викликати біль, але й зменшити запалення та біль.Після застосування типова динаміка тромбоцитів PRP змінює мікрооточення перед відновленням і регенерацією тканин за допомогою різноманітних складних шляхів, пов’язаних з анаболізмом і катаболізмом, клітинною проліферацією, диференціюванням і регуляцією стовбурових клітин.Ці характеристики PRP призводять до застосування PRP у різних клінічних патологічних станах, які зазвичай пов’язані з хронічним болем (таких як спортивні травми, ортопедичні захворювання, захворювання хребта та складні хронічні рани), хоча точний механізм не був повністю визначений.
У 2008 році Evertz та ін.Це перше рандомізоване контрольоване дослідження, яке повідомляє про знеболюючу дію препарату PRP, який отримують з коричневого шару аутологічної швидкості осідання еритроцитів і активують аутологічним тромбіном після операції на плечі.Вони відзначили значне зниження балів за візуальною аналоговою шкалою, використання анальгетиків на основі опіоїдів та більш успішну післяопераційну реабілітацію.Примітно, що вони відображають знеболювальну дію активованих тромбоцитів і припускають механізм вивільнення тромбоцитами 5-HT.Коротше кажучи, тромбоцити знаходяться в стані спокою у свіжоприготованому PRP.Після прямої або опосередкованої активації тромбоцитів (тканинний фактор) тромбоцити змінюють форму і виробляють достатньо фальшивих, щоб сприяти агрегації тромбоцитів.Потім вони вивільняють внутрішньоклітинні α- і щільні частинки.Тканина, оброблена активованим PRP, буде вражена PGF, цитокінами та іншими лізосомами тромбоцитів.Точніше, коли щільні частинки вивільняють свій вміст, вони виділяють велику кількість 5-НТ, який регулює біль.У C-PRP концентрація тромбоцитів у 5-7 разів вище, ніж у периферичній крові.Таким чином, вивільнення 5-HT з тромбоцитів є астрономічним.Цікаво, що Sprott et al.У звіті зазначено, що біль значно полегшився після акупунктури та припікання, концентрація тромбоцитарного 5-HT була значно знижена, а потім рівень 5-HT у плазмі крові підвищився.
На периферії тромбоцити, тучні клітини та ендотеліальні клітини вивільняють ендогенний 5-НТ під час пошкодження тканини або хірургічної травми.Цікаво, що різноманітні рецептори 5-HT нейронів були виявлені в периферійній області, що підтвердило, що 5-HT може перешкоджати ноцицептивній передачі в периферійній області.Ці дослідження показують, що 5-HT може впливати на ноцицептивну передачу периферичних тканин через рецептори 5-HT1, 5-HT2, 5-HT3, 5-HT4 і 5-HT7.
Система 5-HT являє собою потужну систему, яка може зменшувати і посилювати ступінь болю після шкідливої стимуляції.Повідомлялося про центральну та периферичну регуляцію ноцицептивних сигналів і зміни в системі 5-HT у пацієнтів із хронічним болем.В останні роки велика кількість досліджень була зосереджена на ролі 5-НТ та його відповідних рецепторів у обробці та регулюванні шкідливої інформації, що призвело до появи таких препаратів, як селективні інгібітори зворотного захоплення серотоніну (СІЗЗС).Цей препарат пригнічує зворотне захоплення серотоніну пресинаптичними нейронами після вивільнення серотоніну.Він впливає на тривалість та інтенсивність обміну серотоніном і є альтернативним методом лікування хронічного болю.Необхідні подальші клінічні дослідження для чіткого розуміння молекулярного механізму регуляції болю 5-НТ, отриманого з PRP при хронічних і дегенеративних захворюваннях.
Інші дані для визначення потенційного знеболюючого ефекту PRP можна отримати після випробування знеболювальної моделі на тваринах.Порівняльні статистичні висновки в цих моделях є складними, оскільки ці дослідження містять занадто багато змінних.Тим не менш, деякі клінічні дослідження стосувалися ноцицептивного та знеболювального ефектів PRP.Декілька досліджень показали, що пацієнти, які отримують лікування тендинозу або розриву ротаторної манжети, мають незначне полегшення болю.Навпаки, декілька інших досліджень показали, що PRP може зменшити або навіть усунути біль у пацієнтів із дегенерацією сухожиль, ОА, підошовним фасціїтом та іншими захворюваннями стопи та гомілковостопного суглоба.Кінцева концентрація тромбоцитів і біологічний клітинний склад були визначені як ключові характеристики PRP, які допомагають спостерігати постійний знеболювальний ефект після застосування PRP.Інші змінні включають спосіб доставки PRP, технологію застосування, протокол активації тромбоцитів, рівень біологічної активності PGF і вивільнених цитокінів, тип тканини застосування PRP і тип пошкодження.
Варто зазначити, що Куффлер розкрив потенціал PRP для полегшення болю у пацієнтів із хронічним нейропатичним болем від легкого до важкого, вторинним у зв’язку з пошкодженим нерегенеративним нервом.Мета цього дослідження полягає в тому, щоб дослідити, чи можна зменшити або ослабити невропатичний біль завдяки PRP, що сприяє регенерації аксонів і реіннервації цільового нерва.Дивно, але серед пацієнтів, які отримують лікування, невропатичний біль все ще усувається або полегшується принаймні через шість років після операції.Крім того, у всіх пацієнтів біль починався протягом трьох тижнів після застосування PRP.
Нещодавно подібні знеболювальні ефекти PRP спостерігалися в області догляду за післяопераційними ранами та шкірою.Цікаво, що автори повідомили про фізіологічні аспекти ранового болю, пов'язані з ушкодженням судин і гіпоксією тканин шкіри.Вони також обговорили важливість ангіогенезу для оптимізації оксигенації та доставки поживних речовин.Їхнє дослідження показало, що порівняно з контрольною групою пацієнти, які отримували лікування PRP, мали менший біль і значно посилили ангіогенез.Нарешті, Джохал та його колеги провели систематичний огляд і мета-аналіз і дійшли висновку, що PRP може зменшити біль після використання PRP за ортопедичними показаннями, особливо у пацієнтів, які отримують зовнішній епікондиліт та лікування ОА колінного суглоба.На жаль, у цьому дослідженні не було визначено вплив лейкоцитів, концентрації тромбоцитів або використання екзогенних активаторів тромбоцитів, оскільки ці змінні впливали б на загальну ефективність PRP.Оптимальна концентрація тромбоцитів PRP для максимального полегшення болю невідома.У щурячій моделі тендинозу концентрація тромбоцитів становила 1,0 × 10 6 / мкм. При L біль можна повністю зняти, тоді як полегшення болю, викликане PRP з половиною концентрації тромбоцитів, значно знижується.Тому ми заохочуємо більше клінічних досліджень для вивчення знеболювальних ефектів різних препаратів PRP.
PRP і ефект ангіогенезу
Препарати C-PRP у точній регенеративній медицині дозволяють доставляти біомолекули, що вивільняються високою концентрацією тромбоцитів, активованих у ділянках цільових тканин.Таким чином, було ініційовано різноманітні каскадні реакції, які сприяють місцевій імунній регуляції, запальному процесу та ангіогенезу для сприяння загоєнню та відновленню тканин.
Ангіогенез — це динамічний багатоетапний процес, що включає проростання та мікросудини тканини з уже існуючих кровоносних судин.Ангіогенез прогресував завдяки різноманітним біологічним механізмам, включаючи міграцію, проліферацію, диференціювання та поділ ендотеліальних клітин.Ці клітинні процеси є передумовами для утворення нових кровоносних судин.Вони необхідні для росту вже існуючих кровоносних судин для відновлення кровотоку та підтримки високої метаболічної активності відновлення та регенерації тканин.Ці нові кровоносні судини забезпечують доставку кисню та поживних речовин, а також видалення побічних продуктів з оброблених тканин.
Активність ангіогенезу регулюється стимулюючим ангіогенним фактором VEGF і антиангіогенними факторами (наприклад, ангіостатином і тромбоспондином-1 [TSP-1]).У хворому та деградованому мікросередовищі (включаючи низький рівень кисню, низький рН і високий рівень молочної кислоти) локальні ангіогенні фактори відновлять активність ангіогенезу.
Кілька розчинних середовищ, таких як основний FGF і TGF-β і VEGF, можуть стимулювати ендотеліальні клітини до виробництва нових кровоносних судин.Landsdown і Fortier повідомили про різні результати, пов'язані зі складом PRP, включаючи внутрішньотромбоцитарні джерела багатьох ангіогенних регуляторів.Крім того, вони прийшли до висновку, що посилення ангіогенезу сприяє загоєнню захворювання MSK в областях з поганою васкуляризацією, таких як розрив меніска, пошкодження сухожиль та інших областях з поганою васкуляризацією.
Стимулювання та антиангіогенні властивості тромбоцитів
За останні кілька десятиліть опубліковані дослідження довели, що тромбоцити відіграють ключову роль у первинному гемостазі, утворенні тромбів, вивільненні фактора росту та цитокінів, а також регуляції ангіогенезу як частини процесу відновлення тканин.Парадоксально, але PRP α-гранули містять арсенал проангіогенних факторів росту, антиангіогенних білків і цитокінів (таких як PF4, інгібітор активатора плазміногену-1 і TSP-1), і спрямовані на вивільнення специфічних факторів, які відіграють важливу роль. .Роль в ангіогенезі.Отже, роль PRP у контролі регуляції ангіогенезу може бути визначена активацією специфічних рецепторів клітинної поверхні, TGF-β, що ініціює проангіогенні та антиангіогенні реакції.Здатність тромбоцитів здійснювати шлях ангіогенезу була підтверджена при патологічному ангіогенезі та пухлинному ангіогенезі.
Ангіогенний фактор росту тромбоцитів і антиангіогенний фактор росту, отримані з α-А щільних і адгезивних молекул.Найважливіше те, що загальновизнано, що загальний вплив тромбоцитів на ангіогенез є проангіогенним і стимулюючим.Очікується, що PRP-терапія контролюватиме індукцію ангіогенезу, що сприятиме ефекту лікування багатьох захворювань, таких як загоєння ран і відновлення тканин.Введення PRP, точніше введення високої концентрації PGF та інших цитокінів тромбоцитів, може індукувати ангіогенез, ангіогенез і артеріогенез, оскільки фактор 1a, отриманий зі стромальних клітин, зв’язується з рецептором CXCR4 на ендотеліальних клітинах-попередниках.Білл та ін.Припускають, що PRP посилює ішемічну неоваскуляризацію, що може бути наслідком стимуляції ангіогенезу, ангіогенезу та артеріогенезу.У їхній моделі in vitro проліферація ендотеліальних клітин і утворення капілярів були індуковані великою кількістю різних PDG, з яких VEGF був основним ангіогенним стимулятором.Іншим важливим і істотним фактором для відновлення шляху ангіогенезу є синергія між кількома PGF.Річардсон та ін.Було доведено, що синергетична активність ангіогенного фактора тромбоцитарного фактора росту-bb (PDGF-BB) і VEGF призводила до швидкого формування зрілої судинної мережі порівняно з активністю індивідуального фактора росту.Комбінований ефект цих факторів був нещодавно підтверджений у дослідженні посилення церебрального колатерального кровообігу у мишей із тривалою гіпоперфузією.
Найважливіше те, що дослідження in vitro виміряло проліферативний ефект ендотеліальних клітин пупкової вени людини та різних концентрацій тромбоцитів на вибір пристрою для приготування PRP та стратегії дози тромбоцитів, і результати показали, що оптимальна доза тромбоцитів становила 1,5 × 10 6 тромбоцитів/мкм. 50. Сприяти ангіогенезу.Занадто висока концентрація тромбоцитів може пригнічувати процес ангіогенезу, тому ефект буде слабким.
Старіння клітин, старіння та PRP
Старіння клітин може бути викликане різними подразниками.Це процес, під час якого клітини припиняють поділ і зазнають унікальних фенотипових змін, щоб запобігти необмеженому росту пошкоджених клітин, що відіграє важливу роль у профілактиці раку.У процесі фізіологічного старіння реплікаційне старіння клітин також сприятиме старінню клітин, і регенераційна здатність МСК буде знижена.
Наслідки старіння та старіння клітин
In vivo багато типів клітин старіють і накопичуються в різних тканинах під час старіння, серед яких є велика кількість старіючих клітин.Схоже, що накопичення клітин старіння збільшується з віком, пошкодженням імунної системи, пошкодженням тканин або факторами, пов’язаними зі стресом.Механізм клітинного старіння визначено як патогенний фактор вікових захворювань, таких як остеоартрит, остеопороз і дегенерація міжхребцевих дисків.Різноманітні подразники посилять старіння клітин.У відповідь пов’язаний зі старінням секреторний фенотип (SASP) буде виділяти високі концентрації білкових клітин і цитокінів.Цей особливий фенотип пов’язаний зі старінням клітин, у якому вони виділяють високі рівні запальних цитокінів (таких як IL-1, IL-6, IL-8), факторів росту (таких як TGF-β, HGF, VEGF, PDGF), ММП і катепсин.Порівняно з молодими людьми, було доведено, що SAPS збільшується з віком, оскільки стаціонарний процес руйнується, що призводить до старіння клітин і зниження здатності до регенерації.Зокрема, при захворюваннях суглобів і скелетних м’язів.У цьому відношенні імунне старіння вважається значною зміною в спектрі секреції імунних клітин, що вказує на те, що концентрація TNF-a, IL-6 та/або IL-1b збільшується, що призводить до хронічного запалення низького ступеня.Варто зазначити, що дисфункція стовбурових клітин також пов’язана з неклітинними автономними механізмами, такими як старіння клітин, особливо виробництво прозапальних і антирегенеративних факторів через SASP.
Навпаки, SASP також може стимулювати пластичність клітин і перепрограмування сусідніх клітин.Крім того, SASP може організовувати зв'язок з різними імунними медіаторами та активувати імунні клітини для сприяння очищенню старіючих клітин.Розуміння ролі та функції клітин, що старіють, сприятиме загоєнню та ремоделюванню тканин MSK м’язів і хронічних ран.
Слід зазначити, що Ritcka et al.Було проведено широке дослідження, і було виявлено основну та корисну роль SASP у сприянні пластичності клітин і регенерації тканин, а також було введено концепцію тимчасового лікування старіючих клітин.Вони обережно зазначили, що старіння - це переважно корисний і регенеративний процес.
Старіння клітин і потенціал PRP
Оскільки кількість стовбурових клітин зменшується, старіння впливає на продуктивність стовбурових клітин.Подібним чином у людей характеристики стовбурових клітин (такі як сухість, проліферація та диференціація) також зменшуються з віком.Ван і Нірмала повідомили, що старіння призведе до зниження характеристик стовбурових клітин сухожиль і кількості рецепторів факторів росту.Дослідження на тваринах показало, що концентрація PDGF у молодих коней була високою.Вони дійшли висновку, що збільшення кількості рецепторів GF і кількості GF у молодих людей може мати кращу реакцію клітин на лікування PRP, ніж у літніх людей у молодих людей.Ці результати показують, чому лікування PRP може бути менш ефективним або навіть неефективним у пацієнтів похилого віку з меншою кількістю стовбурових клітин і «поганою якістю».Було доведено, що процес старіння хряща змінюється, а період спокою хондроцитів збільшується після ін’єкції PRP.Jia та ін.Він використовується для вивчення фотостаріння мишачих дермальних фібробластів in vitro з лікуванням PRP і без нього, щоб з’ясувати механізм протидії PGF у цій моделі.Група PRP продемонструвала прямий вплив на позаклітинний матрикс, збільшила кількість колагену I типу та зменшила синтез металопротеїназ, що вказує на те, що PRP може протидіяти старінню клітин, а також при дегенеративному захворюванні MSK.
В іншому дослідженні PRP використовувався для збору старих стовбурових клітин кісткового мозку у літніх мишей.Було встановлено, що PRP може відновити різноманітні функції стовбурових клітин після старіння, такі як клітинна проліферація та утворення колоній, і реконструювати маркери, пов’язані зі старінням клітин.
Нещодавно Оберлор та його колеги детально досліджували роль старіння клітин у послабленні регенерації м’язів і оцінили PRP і бідну тромбоцитами плазму (PPP) як варіанти біологічного лікування для відновлення скелетних м’язів.Вони передбачили, що лікування PRP або PPP для відновлення скелетних м’язів базуватиметься на біологічних факторах, адаптованих для специфічних клітинних маркерів SASP та інших факторів, які призводять до розвитку фіброзу.
Розумно вважати, що перед застосуванням PRP цілеспрямоване старіння клітин може покращити регенераційні характеристики ефективності біологічного лікування шляхом зменшення локальних факторів SASP.Було висловлено припущення, що ще одним варіантом покращення результатів лікування PRP і PPP для регенерації скелетних м’язів є вибіркове видалення старіючих клітин за допомогою поглиначів старіння.Немає сумніву, що нещодавні результати досліджень впливу PRP на старіння та старіння клітин захоплюють, але вони все ще знаходяться на початковій стадії.Тому вносити будь-які пропозиції наразі нерозумно.
(Вміст цієї статті передруковано, і ми не надаємо жодних явних чи неявних гарантій щодо точності, надійності чи повноти вмісту, що міститься в цій статті, і не несемо відповідальності за думки цієї статті, будь ласка, зрозумійте.)
Час публікації: 01.03.2023